TECHNIQUE
Cool and Comfort 84 – février 2020
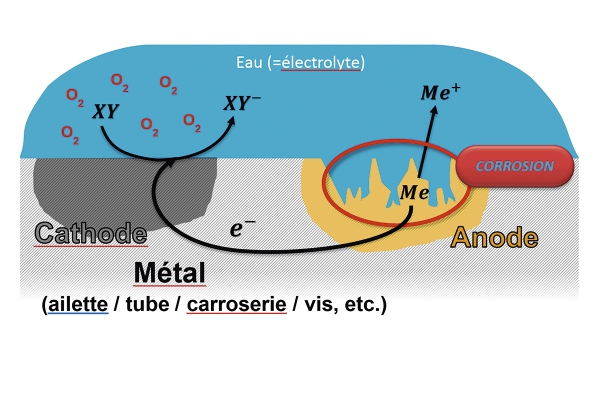
Comment limiter efficacement la corrosion des refroidisseurs
La meilleure conception d’échangeur de chaleur restera, à long terme, inefficace si les matériaux employés n’ont pas été sélectionnés en fonction du milieu ambiant. Dans le cas extrême, cela peut même conduire à ce que tout ou partie d’un appareil se corrode à brève échéance et entraîner son remplacement prématuré. Ce texte donne un aperçu du phénomène de corrosion sur les échangeurs de chaleur. Il expose les différents risques potentiels et présente des possibilités de lutte efficace contre la corrosion dans le cas des refroidisseurs.
Dr. Andreas Zürner, Recherche, Güntner GmbH & Co. KG
Le texte intégral de cet article n’est accessible qu’aux utilisateurs enregistrés. Enregistrez-vous GRATUITEMENT.
Votre compte vous donne un accès complet à tous les sites web de FCO Media: Cool & Comfort, Aquarama, Riorama, Dimension, FM-Magazine, Install Magazine, Techcare, New Security, Maintenance Magazine, Engineeringnet, install.jobs et sites d’événements: New Security, Cool&Comfort Happening, Aquarama Trade Fair et FM-Day.
Après enregistrement GRATUIT :
- Vous lisez des articles complets.
- Vous recevez Cool & Comfort par la poste et vous pouvez lire le magazine en ligne ou le télécharger.
- Enregistrez-vous plus rapidement pour le Cool & Comfort Conferences.